薬機法とは
薬機法とはどんな法令なのでしょうか。よく耳にするであろう「薬事法」との関連性も含めて解説します。
「薬事法」が改正されたもの
薬機法とは「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」を指し、薬事法が改正され再生医療に関する製品の規定が新設されました。
薬事法の歴史は古く、1943年(昭和18年)に制定されました。元々あった医薬品に関する法令をまとめ、医薬品製造の許可や不良医薬品の取り締まりを目的としています。1960年(昭和35年)には薬事法が施行され、医薬品、医薬部外品、化粧品および医療用具について規制しました。その後も改正が繰り返され、医薬部外品の範囲が拡張したり医薬品販売の規制緩和をしたりしています。
安全強化や再生医療の促進が目的
薬事法から薬機法に改正された際、変更になった点はいくつかあります。主な変更点は以下のとおりです。
- ●医薬品と医療機器を区分
- ●添付文書の届出制の導入
- ●再生医療等製品の規定
- ●一般用医薬品のインターネット販売解禁
- ●医薬品、医薬部外品、化粧品、医療機器の広告規制
改正の背景には、医療やIT技術の進歩が挙げられます。「医療機器」は極めて短いサイクルで入れ替わり、「医薬品」と同じように扱うのが困難になったのです。また、薬事法では、医療機器や医薬品の添付文書に最新の知見を反映することは義務付けておらず、再生医療に関しても安全性に疑問がありました。
こうした課題を解決するとともに、新たな医療技術を促進し安全性を強化するため、薬事法は薬機法に改正されたのです。
出典: 医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律|e-gov
2019年の薬機法改正ポイント
2019年11月27日に薬機法は再び改正され、2020年秋ごろから段階的に施行予定となっています。では、どのような点が変更になるのでしょうか。詳しく解説します。
1.先駆け審査指定制度と条件付き早期承認制度の法制化
まず医薬品の承認審査フローで変更があったのが、先駆け審査指定制度と条件付き早期承認制度です。
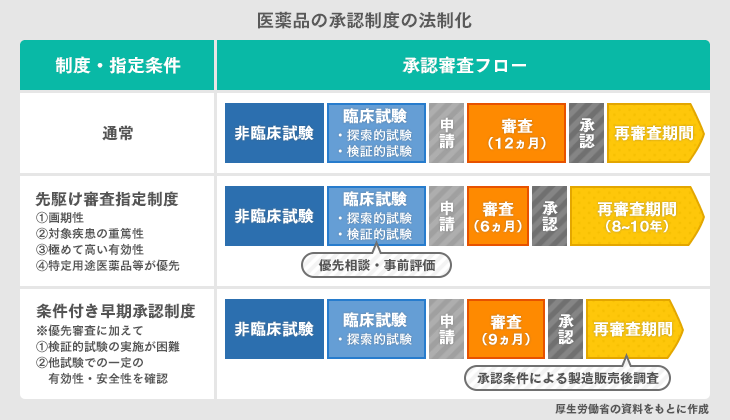
先駆け審査指定制度とは、世界に先駆けて開発され、画期性があり有効性が高いと見込まれる医薬品の承認審査を優先的に行うことです。この制度が法制化されたのは、研究の実用化に関して、世界規模で競争が激化している中、日本は承認審査の遅れが敗因となっているからです。法制化されることで、特定用途医薬品等の臨床試験や承認審査が優先的に行われます。
一方、条件付き早期承認制度とは、患者数が少ないなどの理由で検証臨床試験が難しい医薬品や医薬機器に対して実用化を早めることです。検証的試験以外のほかの試験で有効性・安全性を示せれば、検証的試験を行わなくても承認されます。ただし、製造販売後の調査を行うことが条件です。
この2つの制度が法制化されると、研究の実用化までのプロセスが迅速になり、開発競争力が向上するでしょう。
2.薬剤師や薬局のあり方を見直し
これまでの薬機法によって医薬分業や在宅医療が進みましたが、本来の目的であった患者の服薬情報を管理できていないという現状が課題となっていました。患者本位の医薬分業し、地域医療の役割を果たすため、薬機法の改正で以下のような施策を進めます。
- ●薬剤師が、調剤時以外も必要に応じ患者の服薬状況の把握や服薬指導を行うことを義務化
- ●薬局や薬剤師が、患者の服薬状況を他医療提供施設の医師等に提供することを努力義務化
- ●患者自身が薬局を選択できるよう、地域連携薬局と専門医療機関連携薬局の認定制度を導入
- ●テレビ電話などオンラインでの服薬指導を許可
地域連携薬局と専門医療機関連携薬局の認定に関しては、都道府県知事が行います。地域連携薬局は医療提供施設と連携し、かかりつけ薬剤師・薬局の機能を果たしていることが条件です。専門医療機関連携薬局は医療機関と提携し、がんなどの専門的な薬学管理機能を果たしていなければなりません。
また、オンラインでの服薬指導は全面的に許可しているわけではなく、限定的な運用から試験的に始まる予定です。
3.信頼確保のための体制整備
2014年に改正された薬機法を遵守せず、違反となった例がありました。これを改善するには、業者のガバナンス体制を見直す必要があり、コンプライアンスを徹底するために以下のルールを設けています。
- ●許可等業者に対する法令遵守体制整備の義務化
- ●虚偽・誇大広告による医薬品販売に対する課徴金制度
法令遵守体制整備として、薬事に関する業務に責任を負う役員を決めたり、従業員に対してコンプライアンスの指針を示したり、ガバナンス体制の構築が求められます。さらに、虚偽・誇大広告を抑止するため、課徴金を200万円以下から売上額の4.5%徴収に変更し、高額な設定にしています。
出典: 医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律等の一部を改正する法律の公布について|厚生労働省
医薬品販売への影響
2019年の薬機法改正は、医薬品販売にどのような影響を与えるのでしょうか。注目すべき点をピックアップしました。
原則、添付文書を電子化して提供しなければならない
最新の知見や情報をすみやかに提供するため、添付文書の電子化が求められ、Webサイトなどで見られるよう外箱などにアクセス情報やQRコードを表示しなければなりません。これにより、スマートフォンやタブレットなど端末から、最新状態の添付文書が見られるようになります。
法改正前は、添付文書の内容が頻繁に改定されるにも関わらず、紙で運用されていました。これでは、在庫品の添付文書は古い情報のままである可能性があります。そこで紙の添付文書の同封を廃止し、原則添付文書を電子化しなければならない、としたのです。対象となるのは、要指導医薬品・一般用医薬品等を除く医薬品、一部医療機器となります。
なお、一般用医薬品等は、使用時に添付文書をすぐに確認できるようにしなければならないため、現行のまま同梱します。
医薬品・医療機器の包装や容器にバーコードを表示しなければならない
トレーサビリティを確保するために、国際的な標準化規格に基づくバーコードの表示も義務化されました。医薬品・医療機器の包装や容器にバーコードを付与しなければなりません。製品追跡が可能になるため、在庫管理は効率化され、取り違えなどのミスが軽減するでしょう。
この対象となるのは医療用医薬品で、特定生物由来製品・生物由来製品・注射薬・内用薬・外用薬の5カテゴリになります。
薬機法の改正に対応し、適切な医薬品販売を!
薬事法から薬機法に改正され、2019年には再び薬機法が改正されました。先駆け審査指定制度と条件付き早期承認制度の法制化、服薬指導の義務化、ガバナンス体制の構築などが主な変更点です。これらは2020年秋ごろから段階的に施行されます。今後も薬機法の改正に注意し、適切に医薬品を販売しましょう。
その際、法令対応している販売管理システムを利用すると利便性が高まります。ぜひ導入検討をしてみてはいかがでしょうか。









